| Nyelv : |
|
| Enciklopédia közösség |Enciklopédia válaszok |Küldje el kérdését |Szókincs |Feltöltés ismeretek |
Protein kináz |
  |
|
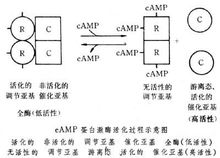
Protein kináz Protein kináz (protein kinázok), más néven protein foszfatáz (fehérje phosphakinase). Egy osztály a fehérje foszforilációs katalizált reakció az enzimet. Ez lehet adenozin-trifoszfát (ATP) a γ-foszfát át a fehérjemolekulák az aminosav maradékok. A legtöbb esetben ez fordul elő a fehérjék foszforilációja maradékok szerin. 50 éve megjelent kifejezés protein-kináz katalitikus kazein, vagy egyéb fehérjéhez phosvitin foszforilációja az enzim. Az 1970-es években egy tucat emlős szövetekben és szervekben is talált egy nagyon fontos osztályát a protein-kináz - ciklikus adenozin-monofoszfát (cAMP)-protein-kináz, később a rovarok és az E. coli számoltak be.Megosztott Protein kináz sejtekben eloszlik a sejtmag, mitokondrium, mikroszómákkal és citoszolba. Általában három kategóriába sorolhatók. ① protein kináz szubsztrát specifikusság: Ha foszforiláz kináz, piruvát dehidrogenáz kináz. ② ciklusos nukleotid függő protein kináz: Amennyiben a ciklikus adenozin-monofoszfát (cAMP) protein-kináz, a ciklikus guanozin-monofoszfát (cGMP) protein-kinázok. ③ más protein kinázok például hiszton kináz. cAMP aktiválja a protein kináz aktiválódik, és a nem-jelenlevő organizmusok két formája, az arányok által irányított különböző hormon szabályozás. cAMP proteinkináz áll 4 alegységből - két cAMP kötődés a szabályozó alegység (R) és két nem-aktivált foszfát csoportok képesek katalizálni az átadás a katalitikus alegység (C). Ha a koncentráció a cAMP intracelluláris cAMP proteinkináz szabályozó alegységek pár disszociációs be, és két katalitikus alegységet kapcsolva (lásd az ábrát). A donor protein kináz aktivátor az ATP és a kalcium (Ca2 ) jelenlétében alacsony aktivitású lehet foszforiláz kináz foszforilációjának, úgy válik a magas foszforiláz-kináz aktivitását, ami viszont csökkenti a sav aktivitását A változás a b enzim aktivitását foszforiláció foszforiláz egy magas, úgy, hogy a glikogén lebomlását simán. Ugyanakkor, és hogy a magas fehérje-kináz aktivitását foszforilációja glikogén szintáz aktivitása alacsony glikogén szintáz b, lassítani a glikogén szintézisét. Annak érdekében, hogy szabályozása alatt cAMP koncentráció kialakulása és lebomlása glikogén metabolizmus egyensúlyt. 1980-as években találtak egy tirozin protein-kináz, amely katalizálja autofoszforilezését lehet foszforilált más fehérjék. Foszforilációs reakció, amely bizonyos meghatározott tirozin hidroxilcsoportja. A metamorfózis egyes tumor vírus fehérjék és néhány növekedési faktor receptor protein tirozin-kináz aktivitást. "[1] Faj Eddig, a protein kinázok már találtak mintegy 300, vagy úgy, van egy homológ molekula körülbelül 270 aminosavat a katalitikus zóna. A jelátvitel, sejtciklus-szabályozás és más rendszerek, protein-kináz alkotott keresztbe hálózat. Ilyen enzimatikus átadása ATP-ből foszfátot és a fehérje kovalens kötéssel kapcsolódnak egy adott molekula egyes szerin, treonin vagy tirozin maradékok hidroxil-csoport, és ezzel megváltoztatja a fehérje konformációját és az enzim aktivitását. Fehérje foszforiláció adenozin-trifoszfát (ATP) alsó (γ-bit)-foszfát szubsztrát át a fehérje aminosav végzett egy adott kovalens módosítás egy osztály a reakció kombinálható. Ezek a protein-kináz katalitikus reakciók. Osztható ciklikus adenozin-monofoszfát (cAMP) - függő protein kináz: ciklikus guanozin-monofoszfát (cGMP) - függő protein-kináz, a kalmodulin-függő protein-kináz-és foszfolipid-érzékeny kalcium-függő protein-kináz. Általában által katalizált a protein kináz foszforilációs hely, hogy elfogadja egy foszfát csoport szerin, treonin, tirozin vagy hidroxilcsoport. Sok protein-kinázok, alapuló szubsztrát proteinek foszforilált aminosav-típusú, akkor lehet öt csoportba oszthatók, nevezetesen: ① szerin / treonin (Ser / Thr) kináz: fehérje foszforilációját hidroxilcsoportok; ② tirozin (Tyr) protein-kinázok: fehérje receptor fenolos hidroxil-csoport, mint a foszfor; ③ hisztidin protein kinázok: fehérje hisztidin, arginin vagy lizin a bázisos csoportokat foszforilált, elsősorban a "két-komponensű jelátviteli rendszer" (kétkomponensű jel rendszer); Protein Kinase ④ triptofán: triptofán maradékot a fehérje, mint a foszfor-receptor; ⑤ aszpartil / glutamil kináz: a csoport egy foszfát receptor fehérje. Jelenleg megtalálható az előző három osztályba növényi alapú protein kinázok. A kő-és Walker (1995) alapján az aminosav szekvenciája a protein kináz katalitikus régiót hasonlóság, a növényeket öt csoportra osztottuk a protein-kináz. Ez az öt hiszton kináz voltak ① AGC Csoport: cAMP (ciklikus adenozin-monofoszfát)-függő protein kináz PKA, cGMP (ciklikus guanozin-monofoszfát) függő proteáz PKG-és kalcium-függő protein kináz PKC lipid képviselte, hogy másodlagos hírvivők (például cAMP, cGMP, DAG (diacilglicerin) és a Ca2 ) jellemzi aktiválást. ② CaMK Csoport: többek Ca2 / CaM-függő protein kináz CaMK, Ca függő és CaM-függő protein kináz CDPK nem annyira függ a második messenger protein kináz egyetemességének a csoport. ③ CMGC Csoport: többek MAPK (mitogén-aktivált protein kináz), CDK (ciklin-függő protein kináz), stb, viszonyítva az előző két hiszton kináz-függő a második messenger, a csoport hat a downstream kináz foszforilációs kaszkád rendszer . ④ hagyományos PTK csoport: protein-tirozin-kináz a növényekben jelen találtak egy tiszta fehérje tirozin-kináz, de ez nem jelenti azt, hogy a Tyr foszforilációja maradványok a növényi anyag. Dupla-specifikus protein-kinázok, mint például megtalálható a növényekben MAPKK, hogy a Tyr maradékok foszforilációját a magasabb rendű növényekben lehet fontos fiziológiai szerepet. ⑤ más csoportok: mint például a RLKs osztály és az etilén-receptor-protein-kináz szignáltranszdukciós elem ctrl (citoplazmikus protein kináz kaszkád MAPKKK), és így tovább. |
| Használó Felülvizsgálati |
|
Nincs még hozzászólás |